疼痛被认为是一种感觉概念。这种令人不舒适的感觉是生物体是对周围刺激的反应:当外界环境使我们处于受到伤害的风险时,痛觉会作为一种防御机制形式功能,使得生物体有机会躲避伤害。这种机制,已经被深刻地植入到生命的机能中。本文将从以下几个方面展开Part-1:介绍Part-2:机制 Part-3: 分类Part-4:靶点Part-5:结语
Part-1:介绍人们对疼痛的感受不尽相同,有时甚至会有极大的差别体验,同时对于疼痛也存在各种分类方式,在本文中笔者会试着从诱发疼痛的原因,对其做一个大致的分类1,2,3:疼痛有两种基本类型:神经性(神经损伤)疼痛-- Neuropathic (nerve injury) pain 和伤害性(组织)疼痛--Nociceptive (tissue) pain. 神经病理性疼痛是由神经系统的原发性病变或功能障碍引起的,在受损组织愈合后会持续很长时间,并可转化为慢性疼痛;当伤害感受器是由受损或发炎组织刺激时,就会发生伤害性疼痛。这类疼痛通常是有时间限制的具有有保护作用。也有学者将炎症引起的疼痛单独分为一个类型,下文的分类章节笔者也采用了这样的处理,聚焦于三种常见的痛觉体验:外界伤害性刺激导致的疼痛(nociceptive);炎症导致的疼痛(inflammatory)以及诸如如神经病理性疼痛(neuropathic)。痛觉感受与初级传入纤维(primary afferent fibers)中受体的激活有关,初级传入纤维包括无髓鞘C-fiber和有髓鞘的Aσ-fiber。在没有伤害性刺激(noxiousstimulus)存在的前提下,这些部位的痛觉感受器都处于静默的状态,在有害刺激出现的情况下会被激活。大脑需要感知一系列感觉性的事件(sensory event),以实现感知疼痛并对威胁做出规避反应。大脑感知痛觉,可以划分成三个阶段;第一阶段是痛觉信号敏感化(sensitivity),第二阶段是信号从外周传递到背角(DH),后者位于脊髓内,并链接了外周神经系统(PNS)。最后,第三个阶段是通过中枢神经系统(CNS)将信号传输到大脑。中枢神经系统(CNS)和周边神经系(PNS)都参与了痛觉感知的信号通路。PNS 包括位于大脑和脊髓之外的神经和神经节,主要用于将CNS连接到我们身体的器官和四肢。CNS由脊髓和大脑组成,主要负责整合和处理PNS发出的信息,然后协调我们身体的所有活动,并向效应器官发出指令4。Part-2:机制从生理机制的角度来看,痛觉的产生经历了三个事件(event),包括信号转化(transduction),信号传输(transmission)以及信号调控(modulation)。在人类的身体中,存在三类神经元,它们都参与了痛觉的生理机制。这三类神经元包括了感觉神经元(传入神经元--Sensory neurons);中间神经元(Interneurons),其功能为传递传入和传出神经元之间的信号;以及运动神经元(传出神经元--Motor neurons)Sensoryneurons:----感觉神经元将来自体内组织和感觉受体获取的信息向内传递到脊髓和大脑Interneurons:----位于大脑和脊髓内的中间神经元相互交流并处理感觉输入和运动输出之间的信息Motorneurons:--运动神经元将指令从中枢神经系统传送到肌肉和腺体,引起肌肉收缩运动或腺体分泌TheBig Picture of Detection and Interpretation of pain:
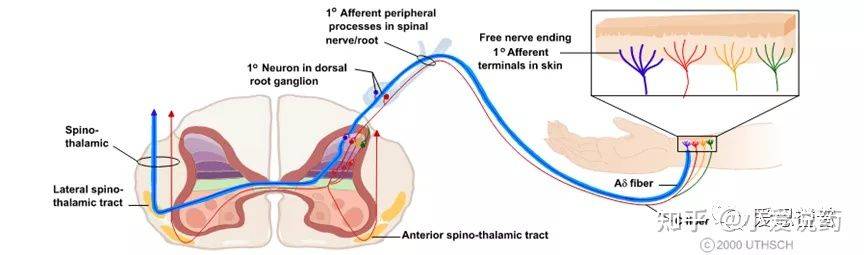
(https://nba.uth.tmc.edu/neuroscience/m/s2/chapter06.html)
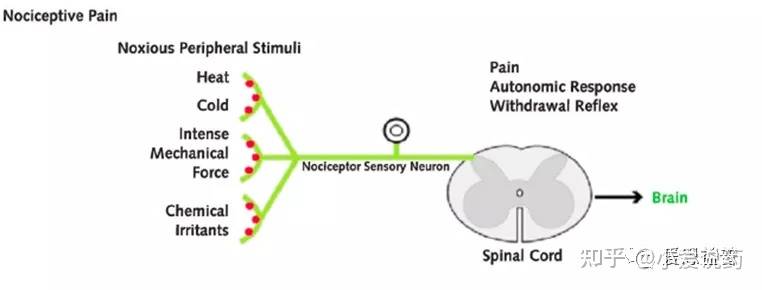
各种神经元在体内相互勾连,形成的复杂和精细的神经网络。痛感的形成过程中,化学和电学信号通过神经元之间特化的生理结构--突触,进行转化和传输:神经元通过树突或者胞体(dendrites and soma)处的突触来接受其他神经元输送的信号(synaptic transmission)。这种突触传递的信号,可以是兴奋性的(促进细胞膜电位去极化)也可以是抑制性的(减弱细胞膜去极化)。神经元通过突触结构,实现了化学能和电学能信号的转化(transduction),这样的转化机制,也为药物干预提供了可能。当从树突或者胞体接收到信号后,神经元可以沿着轴突进行信号传输(transmission),这一过程会在神经元内部产生一系列短促的脉冲冲动(就是动作电位),它们会从胞体出发发,沿着轴突传送并激活突触,进而把痛觉信号呈递到下一个神经元。同时,信号调控(modulation)可以在痛觉感受信号通路(nociceptive pathways)的各个层面发生:初级传入神经元、脊柱背角和更高级的大脑中枢,各个维度对痛觉信号进行干预控制(上调或者下调)。痛觉感受器(Nociceptors)是一种外周感觉神经元,其轴突游离的神经末梢(free nerve endings),遍布在皮肤、肌肉、关节、骨骼和内脏。痛觉感受器(Nociceptors)的胞体主要位于背根神经节和三叉神经节。三叉神经节(TG)包含许多支配头部的感觉神经元,而背根神经节(DRG)主要支配身体的其余部分7。目前,在中枢神经系统内未发现伤害感受器。近来,人们发现神经末梢含有较多的TRP通道的表达,这类通道可以感知和检测损伤。它们能够将各种有害刺激转化为受体电压信号(Receptor potential),进而启动感觉神经元的轴突的动作电位。这种动作电位将会被传递到脊髓,最终进入中枢神经系统。在周边神经系统中,感觉神经元的轴突将痛觉感受器产生的痛觉信号,从身体各部位传递到脊髓。轴突是痛觉感受中重要的组成部分,轴突其实就是神经纤维(nerve fibers),主要承担了动作电位传递功能。轴突可以是有髓鞘或无髓鞘的两种形式。髓鞘具有绝缘和保护轴突的功能,在有髓鞘的神经纤维中,每两个施万细胞(一种神经胶质细胞)之间的无髓鞘部分形成郎飞氏结(node of Ranvier)。该处的轴索是裸露的,这有利于在相邻的两个结之间形成局部电流,使兴奋以跳跃的方式传导,大大加快了有髓鞘纤维的传导速度;在无髓鞘的神经纤维中,动作电位以连续的形式传递动作电位,这样动作电位传递速度相比有髓鞘纤维就会较慢。神经纤维可以进一步分类5。C-fiber是一类髓鞘的神经纤维,可以传递多种痛觉感受器(Nociceptors)产生的痛觉信号,据报道这一类纤维携带并集合了约为70%以上的痛觉信息(nociceptive information)。C-fiber相关的痛觉感受器的感受区域较大,对疼痛定位不够精确;Aσ-fiber是一类有髓鞘纤维,被认为主要传递来自于感受机械热刺激以及有害机械刺激的痛觉感受器的痛觉信息,这些痛觉感受器的感受区域较小(receptive fields),因此,可以提供精确的疼痛定位。 动作电位是痛觉信号在神经系统中主要的传递形式。神经元轴突的静息膜电位一般在-70mV左右,而其产生动作电位释放的阈值在-55mV左右。痛觉感受器(Nociceptors)的激活8需要足够强度的刺激,以足够的幅度和持续时间去极化外周终末--Peripheral terminals(让外周终末产生受体电位--Receptor potential)。在这里我们简答的定义一下:什么是外周终末--Peripheral terminals和受体电位--Receptor potential。成熟的痛觉感受器的外周终末(Peripheral terminals)是指能够检测到有害的理化刺激刺激并将其转化为电学变化的区域,这一区域具有特化的树型结构,并含有多种TRP通道,双控钾通道, Kv3.4、Kv4.3,以及Nav1.8。通过这些通道的作用,去极化外周终末即产生受体电位--receptor potential。受体电位(Receptor potential)指的就是由于将理化刺激转化成电学变化,而导致的在痛觉感受器外周终末的膜电位变化。尽管在从外周终末(理化刺激转变离子流的区域)到动作电位产生部位之间的被动传输中,受体电位会有所衰减,但其诱发的动作电位还是能够将刺激强度等信息编码在产生的脉冲序列中。痛觉感受器表达多种电压门控通道(如Nav、Cav、Kv),这些电压门控通道可以将受体电位转换为动作电位,或者更准确地说是一系列动作电位。这些电位脉冲的作用在于编码了痛觉感受器接受到的有害刺激的强度4,8。感觉神经元可兴奋性的变化,在各种病理以及炎症作用下的痛觉感受中起到了重要的角色;而细胞的兴奋性以及动作电位的关键参数(e.g., threshold for action potential generation, actionpotential and undershoot amplitude and duration, and maximal firing frequency)受到痛觉感受器中多种电压门控通道以及对动作电位释放频率起调节作用的通道(HCN,Kv3.4以及Kv4.3)的协同影响,这也为镇痛类药物的设计,提供了思路。当动作电位到达轴突末端时,钙离子通过电压控制的钙离子通道进入突触前。钙离子的进入,促进了突触囊泡和突触前膜的融合,通过胞吐作用,将神经递质释放到突触间隙中。游离的神经递质,可以和毗邻神经元突触后膜上的相应地配体门控通道相结合,而产生局部的动作电位。这样实现了痛觉信号在不同神经元之间的传递。当痛觉被传递到脊髓之后,脊髓背角(DH)在整合包括初级传入神经元和局部中间神经元网络在内的各种进入脊柱的信息中发挥了关键的作用。在上行性系统中,初级传入痛觉感受器负责将接收到的有害信息传递给脊髓背角(DH)的投射神经元,随后,这些投射神经元将获得感觉信息处理整合后传递到丘脑,通过脊髓丘脑束到达躯体感觉皮层,从而提供有关有害刺激位置和强度的信息。中脑导水管周围灰质(periaqueductal gray - PAG)在这一过程中占有重要的位置。中脑导水管周围灰质属中脑边缘系结构,也是内源性阿片肽神经元的重要分布区。与整合本能行为、调控内脏功能活动、致痛与镇痛及海洛因成瘾与戒断等有关。在痛觉传递过程中,PAG接受并调控了来自脊髓背角(DH)的信息,并呈递至更高一级的中枢神经系统中。内源性阿片和大麻素系统以及其他神经递质,如5-羟色胺(5-HT)和去甲肾上腺素(NE)系统在PAG通路中大量表达。Part-3:分类通常,根据症状、机制和综合征等三个特征,疼痛可分为三种类型:伤害性疼痛(nociceptive pain)、神经性疼痛( neuropathic pain)和炎症性疼痛(inflammatory pain)。伤害性疼痛(nociceptive pain):这一类痛感,是我们身体中的感觉神经元系统(sensory nervous systems)对于实际发生的或者潜在的有害刺激的反应。被这种刺激活的感觉末梢(sensory endings)被称为痛觉感受器(nociceptors),它主要负责疼痛感觉的第一阶段。从根本上说,Aσ-fiber和C-fiber是两种主要的传入痛觉感受器(primary afferent nociceptors)9,主要应答了身体中出现的伤害性刺激。这两种伤害感受器都有特化的树形游离神经末梢(free nerve endings),这些游离末梢广泛分布于皮肤、肌肉、关节囊、骨骼和一些主要脏器中。它们可以被各种有害的化学、机械的刺激以及冷热刺激等所激活,并将这些刺激型号转化成电信号。初级传入神经元(primary afferent neurons)中的受体,因通道类型而异主要产生三种效应,即兴奋性、致敏性以及抑制性。一旦这些受体受到刺激并达到痛阈,由此产生的电压脉冲沿着传入纤维(afferent fibers)向周边神经系统中的脊髓背角(DH)以及进一步向中枢神经系统传递,最终形成痛觉。
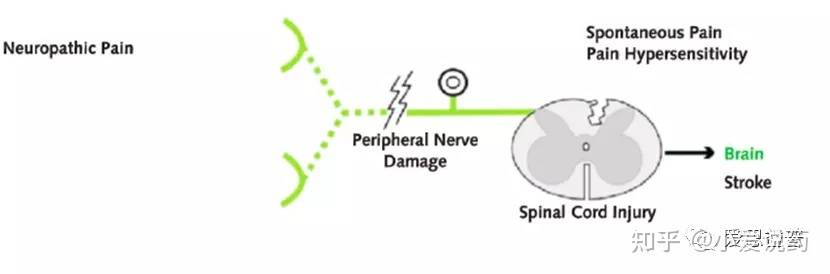
神经性疼痛(neuropathic pain)神经病理性疼痛通常被描述为神经损伤或神经损伤,通常与痛觉超敏(Allodynia)10有关。痛觉超敏指的是一种由通常不会引起疼痛的刺激,所引起的疼痛感。有大量证据表明,中枢神经系统致敏效应(Central sensitization)导致了痛觉超敏症的出现。中枢神经系统致敏效应,指的是中枢神经元可塑性的变化(activity and transcription dependent),对阈下刺激产生痛觉反应,这一过程涉及感觉神经元和中枢(脊髓背角-DH)神经元之间突触效能的变化,增加对疼痛尤其是在损伤原发部位附近的区域痛觉的感知。这一致敏作用是对受体进行重复性非疼痛刺激的结果。NMDA受体在中枢神经系统致敏效应(Central sensitization)触发和维持中发挥了重要的作用13,同时包括Substance P (SP),CGRP,BNDF,5-HT,bradykinin等多种化学分子都促进了中枢神经系统致敏效应。除了中枢神经系统的致敏作用,受损的轴突也会表现出生理特性的改变,进而在受损部位发展出自发的高可兴奋性,例如在神经痛发作期间,Nav1.7/1.8的表达都会有所变化,产生异位放电(Ectopic discharge)进而促进细胞的兴奋性11。神经性疼痛可由神经损伤引起,进而影响躯体感觉系统;也可能由PNS或CNS的紊乱引起。神经性疼痛是一种“病理性”疼痛,因为它对身体的防御系统没有任何帮助。
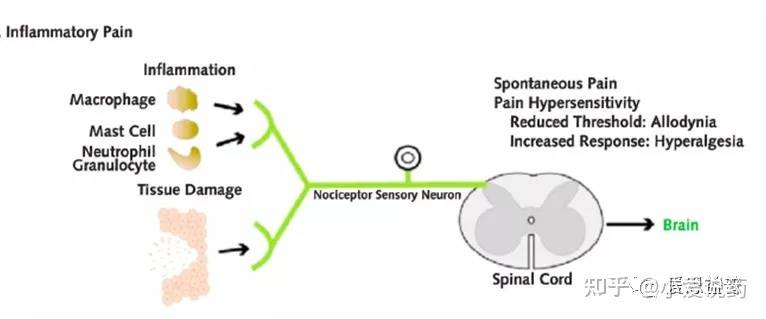
炎症性疼痛(inflammatory pain)炎症是人体内组织对有害刺激产生的自然生物反应,目的是清除坏死细胞并启动组织修复过程。炎症性疼痛是由与炎症相关的组织损伤引起的,在组织损伤或者炎症发生的部位,会产生多种炎症因子,细胞因子以及趋化因子,包括5-HT、激肽、组胺、神经生长因子(NGF)、三磷酸腺苷(ATP)、PG、谷氨酸、白三烯、一氧化氮(NO)、NE和质子。这些调节因子可以结合并激活位于突触后神经元的受体或通过激活第二信使通路,主要调节了离子通道(e.g: Nav1.7/1.8)的生理活性12,协同作用激活毗邻的痛觉感受器,提高了初级传入神经元的可兴奋性(primary afferent neurons)以及痛觉感受器对刺激的敏感度(外周致敏-- Peripheral Sensitization)。同时,炎症性疼痛还可以提高初级传入神经系统对脊髓背角(DH)疼痛信息的输入,进而引起中枢神经系统致敏效应。
痛觉感受器敏感化的特点是存在自发异位放电(spontaneous ectopic discharges)、激活阈值降低和对刺激的反应性增加。这些改变导致痛觉过敏(hyperalgesia)、痛觉超敏(allodynia)和自发性疼痛的发生。同样,这些也是神经性疼痛(neuropathic pain)中出现的表型症状。
Part-4:靶点在痛觉传递和感知的过程中,涉及到的靶点较为广泛,我们在这里简要介绍部分离子通道在痛觉感知中的作用。疼痛由DRG神经元感知并传递到中枢神经系统,该神经元在功能可进一步细分1.痛觉感受器外周终末,可以检测引起疼痛的各种刺激(机械感觉、热感觉和痛觉);2.传导痛觉信号的轴突(Axon);3.突触前终端,将信号向前传输到下一个神经元,并最终到大脑,在那里信号被感知为疼痛;离子通道在疼痛感知, 痛觉传递以及痛觉呈递至中枢神经系统的过程中,都发挥了至关重要的作用。痛觉感知:痛觉感受器(Nociceptors)的外周终末(Peripheral terminals)拥有多种离子通达,可以感知和转化外部刺激,产生可传递和编码的电信号以及调控细胞膜兴奋性8。Transient Receptor Potential Channel (TPRP):TRP通道具有有害理化刺激并转化法膜电位信号的功能。温度低于15°C或高于43°C都会会引起热感觉和疼痛感。几种TRP家族的成员都是热敏离子通道。每个通道表现出不同的热激活阈值;TRPV4(>25℃)、TRPV3(>31℃)、TRPV1(>43℃)、TRPV2(>52℃)、TRPM8(<28℃)和TRPA1(<17℃)。其中TRPV1和TRPM8作用,研究比较透彻。有研究报道,一些炎症调节因子,例如ATP和缓激肽(bradykinin)可分别通过P2Y2和B2受体,增强在DRG神经元中TRPV1的作用;同时。TRPV1自身的表达,在炎症条件下也会升高。另外,TRPV1,v4以及TRPA1也参与到急性的刺痛(Intense punctate)的感受中。P2X ReceptorsP2X3受体作为同聚体和异聚体(P2X3/P2X2)在DRG的伤害性感觉神经元上高度表达。受损或炎症细胞释放ATP可以激活此类P2X3受体,启动痛觉信号。有报道,同聚体和异聚体形式的P2X3受体的选择性非核苷酸拮抗剂(A-317491)显示出对损伤和慢性伤害性疼痛的减轻Acid Sensing Ion Channels (ASICs)组织酸中毒与炎症有关,是疼痛的重要来源;在炎症过程中,细胞外pH值降低(低于pH=6),可以激活算敏感通道(ASICs),其实痛觉传递。ASICs介导了钠离子,可以促进细胞膜兴奋。在疼痛方面,最令人关注的是ASIC3,它主要在DRG神经元中表达,这使其成为疼痛的一个很好靶点。另外,TREK-1,TRAAK,Kv3.4以及KV4.3等钾通道都在痛觉感受器(Nociceptors)对于各种有害刺激的痛觉觉察中扮演了一定的角色痛觉传导Voltage Gated Na+ Channels痛觉感受器表达多种电压门控通道,它们可以将受体电位转换为动作电位,或者更常见的是,转换为一系列动作电位,进而利用这种方式对他们身体内施加的有害刺激进行强度编码。 电压门控钠通道是包括初级感觉神经元在内的轴突传导的关键承担着。Na1.7是在DRG中主要表达的一种TTX敏感的钠离子通道,也是被研究者关注的疼痛缓解的靶点;两种TTX不敏感的钠离子通道:Nav1.8 和Nav1.9在小DRG细胞中广泛表达。抑制NaV1.8通道已被发现能有效减轻躯体传入轴突损伤或组织炎症后的疼痛.这类钠离子通道,也收到了多种炎症因子的调控。痛觉信号传递至中枢神经系统Voltage Gated Ca2+ Channels电压门控钙通道(VGCC)也在疼痛感受器中表达,主要分布在背角的DRG神经元突触前终末,它们控制神经递质的释放,进而将痛觉信号传递至中枢神经系统。已有文献报道,多种钙离子通道参与到这一过程:N-type, T-type以及P/Q type等钙离子通道。以上仅是列举部分参与到痛觉感知的离子通道。其实,参与到这一过程的离子通道和GPCR的种类很多。例如上文没有提及的NMDA受体,也是疼痛重要的靶点。NMDA受体,尤其是分布于脊髓背角的NMDA受体,在突触可塑性中起着关键作用,长期以来一直是靶点用于治疗神经性疼痛。除了在背根神经节(DRG)神经元的中枢终末(central terminals)中表达外,支配躯体组织的初级传入神经的外周末梢(peripheral terminals)也有表达。NMDA受体被认为是中枢神经系统的致敏作用(central sensitization)以及脏器痛觉感受(Visceral Nociception)中都发挥了重要作用;AMPA受体在脊髓(Spin cord)也有表达,参与到了脊髓背角中枢神经系统的致敏作用(central sensitization)。Part-5:结语在我们实验室,构建了全面的疼痛相关的离子通道,GPCR以及各种酶类相关靶点,同时具有多个成熟的疼痛动物模型,也建立成熟的研究平台,积累的丰富的疼痛研究的相关经验。相信可以为疼痛相关的基础研究和新药开发,做出一份有价值的贡献。Ref:1. Abd-Elsayed A., Deer T.R. (2019) Different Types of Pain. In:Abd-Elsayed A. (eds) Pain. Springer, Cham. 2.https://www.webmd.com/pain-management/guide/pain-types-and-classifications3. Schaible HG. Peripheral and central mechanisms of pain generation.Handb Exp Pharmacol. 2007;(177):3-28.4. Yam MF, Loh YC, Tan CS, Khadijah Adam S, Abdul Manan N, Basir R.General Pathways of Pain Sensation and the Major Neurotransmitters Involved inPain Regulation. Int J Mol Sci. 2018 Jul 24;19(8):2164.5. Hall, J.E. Guyton and Hall Textbook of Medical Physiology e-Book;Elsevier Health Sciences: Philadelphia, PA,USA, 2010.6. https://www.biologyonline.com/dictionary/ganglion7. Lopes DM, Denk F, McMahon SB. The Molecular Fingerprint of Dorsal Rootand Trigeminal Ganglion Neurons. Front Mol Neurosci. 2017 Sep 26;10:304. 8. Dubin AE, Patapoutian A. Nociceptors: the sensors of the pain pathway.J Clin Invest. 2010 Nov;120(11):3760-72.9. Ma, C.; Zhang, J.M. Animal Models of Pain; Humana Press: New YorkCity, NY, USA, 2010.10. https://en.wikipedia.org/wiki/Allodynia11. Hameed S. Nav1.7 and Nav1.8: Role in the pathophysiology of pain. MolPain. 2019 Jan-Dec;15:1744806919858801.12. Hucho T, Levine JD. Signaling pathways in sensitization: Toward anociceptor cell biology. Neuron. 2007;55(3):365-37613. Woolf CJ; American College of Physicians; American PhysiologicalSociety. Pain: moving from symptom control toward mechanism-specificpharmacologic management. Ann Intern Med. 2004 Mar 16;140(6):441-51.
公司介绍
关于爱思益普北京爱思益普生物科技股份有限公司2010 年成立,专注于从先导化合物筛选,优化到临床前候选分子阶段基于细胞和生化的药物体外筛选技术和早期药物机理研究,关注肿瘤,免疫,心血管,中枢神经系统等疾病领域的生物学和药理学研究技术,打造创新型CRO+的探索者。