今年 8 月 24 日,国家自然科学基金委员会揭晓了 2023 年国自然评审结果,自噬相关研究的中标数量高达 518 项!(来源:ZCOOL 国自然项目查询系统)
言归正传!自噬,一种针对细胞内各种成分进行降解的基本过程。谁来降解?溶酶体;降解谁?细胞内的各类大分子和亚细胞成分,例如核酸、蛋白质、脂质和细胞器等。
自噬可以是非选择性的,细胞质物质被隔离到自噬体中进行吞噬,通常在营养缺乏时发生。相比之下,选择性自噬会降解特定靶标,例如受损的细胞器:线粒体自噬、溶酶体自噬、内质网自噬等等,从而在细胞质量控制中发挥重要作用 (图 1)[1][2]。



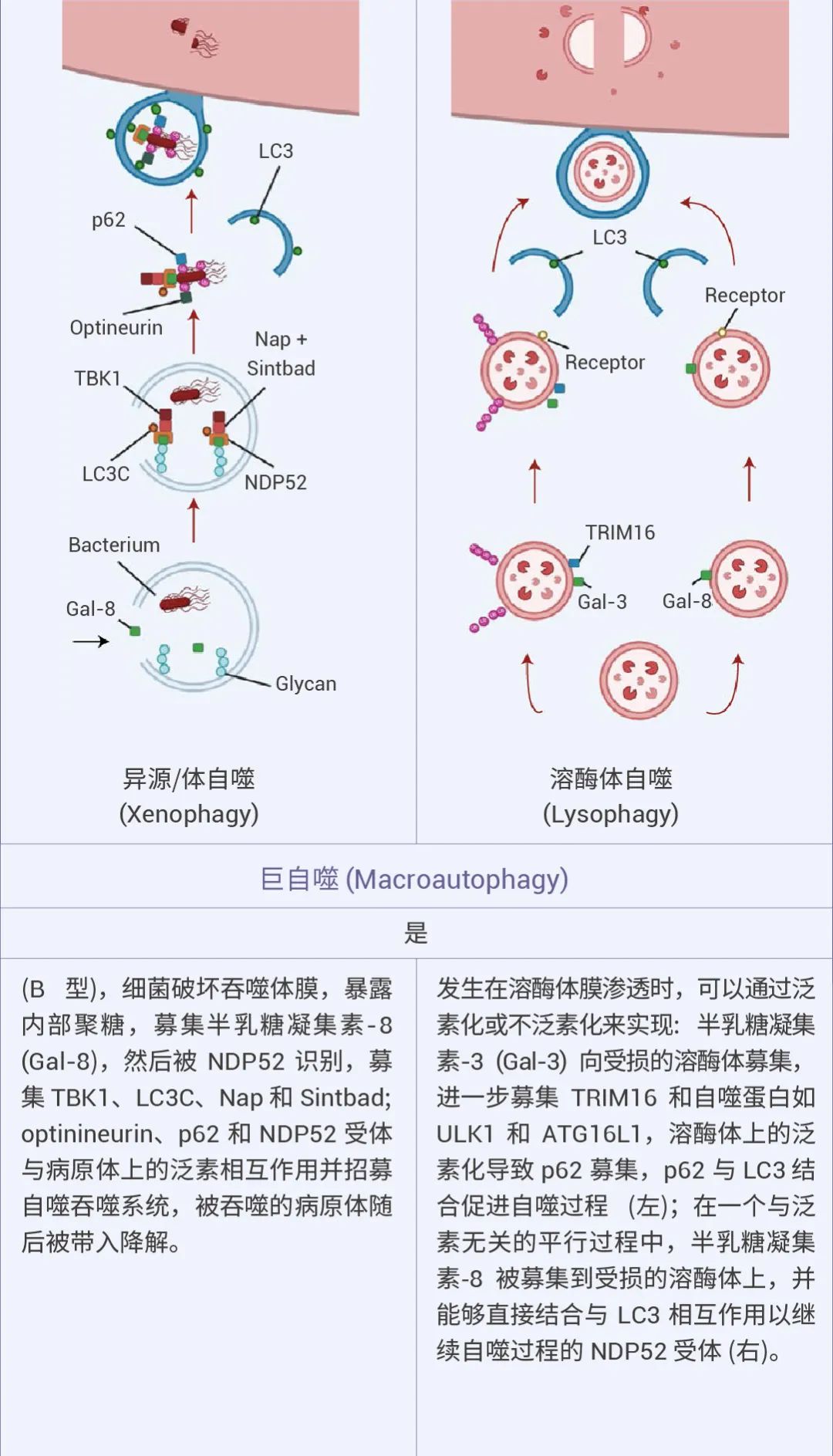
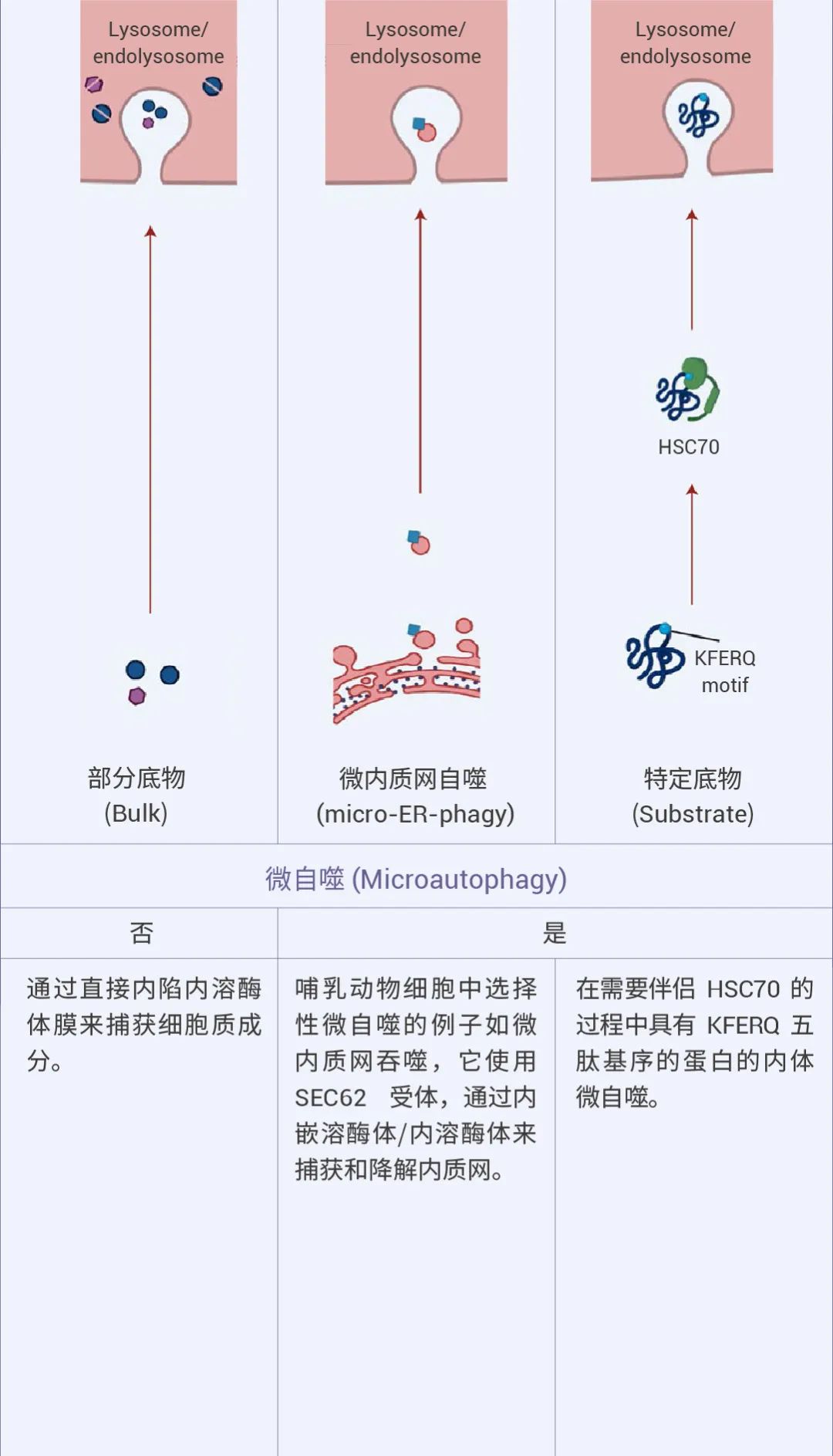

图 1. 不同的自噬机制及特点[2]。

自噬是一个高度集成的过程,通过促进细胞存活或导致细胞死亡来维持细胞稳态[3][4]。
▐ 自噬介导的细胞保护作用
自噬的主要功能是通过回收必要的细胞成分来促进应激/营养限制后的细胞存活。自噬由营养和能量应激、缺氧、氧化还原应激和线粒体损伤等多种刺激诱导[4]。


 图 2. 氧化应激通过多种机制诱导自噬[5]。
图 2. 氧化应激通过多种机制诱导自噬[5]。
(A-D): 响应饥饿调节自噬的主要信号转导途径概述。(E-H):诱导自噬的特定应激途径概述:缺氧 (E);氧化损伤增加 (F); p53系统的干扰 (G)或线粒体功能障碍 (H) 诱导自噬的机制示意图。
例如,当细胞在同时缺乏营养和生长因子的情况下培养时,自噬到达最高水平[6]。而在小鼠中,饥饿 24-48 h 后,大多数组织中的大多数细胞显示出自噬体数量增加[7]。其次,细胞必须清除受损的线粒体,以防止 ROS 积聚[5]。当然,某些应激途径如中度缺氧时,也会诱导自噬,防止细胞死亡 (图 2)[5][8]。
▐ 自噬诱导细胞死亡
自噬经常在细胞死亡中观察到,在某些情况下,抑制自噬可以防止细胞死亡[9]。由于不同信号通路之间的广泛串扰,自噬的促死亡作用非常复杂[10]。

今年 3 月,Jiao Liu 等人报道了 TMEM164 在铁死亡期间 (而不是饥饿期间) 选择性介导 ATG5 依赖性自噬体形成中的关键作用。TMEM164 通过激活自噬降解铁蛋白 (Ferritin)、GPX4 和脂滴,以增加铁积累和脂质过氧化,从而促进嗜铁细胞的死亡。TMEM164 的缺失限制了小鼠体内铁死亡介导的细胞毒性的抗癌活性,建立了自噬依赖性铁死亡的新模式[11]。


图 3. TMEM164 在自噬依赖性细胞死亡中的作用[11]。
铁死亡激活剂 (如 RSL3) 会诱导 TMEM164 依赖性自噬体形成,导致抗铁死亡调节因子 (如 GPX4、FTH1 和脂滴) 选择性降解。

研究表明,GX15-070 可通过增加自噬体的积累来诱导自噬,并促进 Atg5 (自噬体膜的一个组成部分) 与坏死体 (Necrosome) 的关键成分,即 FADD、RIP1 和 RIP3 的相互作用,触发坏死体在自噬体上的组装。这导致细胞质细胞死亡信号复合物的形成,引发坏死性细胞死亡[12]。


图 4. GX15-070 通过促进坏死体在自噬体上的组装来触发坏死性凋亡[12]。
自噬在癌症中具有的双重作用,具体取决于癌症的类型和阶段[10][13]。
一方面,自噬可以促进肿瘤的发生和转移,目前 FDA 批准的唯一自噬抑制剂是 Chloroquine 和 Hydroxychloroquine[14]。另一方面,自噬可以通过自身或与其他细胞死亡途径协同促进细胞死亡来增强癌症治疗的功效 (表 1)[10]。
表 1. 诱导自和细胞死亡的药物治疗[10]。


随着自噬研究热度的增加,其相关检测也成为科研“汪”们的密切关注。细胞自噬体的数量和自噬通量常作为细胞自噬活性水平的指标。
▐ 监测自噬体的数量
目前使用三种主要方法来监测自噬体的数量,包括电子显微镜、光学显微镜检测 LC3 的亚细胞定位以及生化检测 LC3 的膜相关形式[15]。
最传统的方法是电子显微镜,通过观察样品判断是否有自噬泡样结构出现。电镜下,发生自噬的细胞可见损伤的细胞器如线粒体的肿胀变性,其周围有空泡状双层膜样结构,或双层膜环绕线粒体形成自噬体,也可见自噬溶酶体内最终不能降解的残体等 (图 5 和图 6A)[15][16]。


图 5. 自噬体和自溶酶体形态[15]。
其次,哺乳动物自噬蛋白 LC3 是自噬体的标志物,可通过更广泛使用的光学显微镜和生化方法所检测。内源性 LC3 或 GFP-LC3 通过荧光显微镜观察为弥散的细胞质池或主要代表自噬体的点状结构 (图 6 B-C)。
▐ 监测自噬通量
目前测量自噬通量的主要方法之一是监测 LC3 周转率,当用溶酶体试剂 (如氯化铵、Chloroquine 或 Bafilomycin A1) 或溶酶体蛋白酶抑制剂 (如 E64d) 处理细胞时,LC3-II 的降解被阻断,导致 LC3-II 的积累。因此,样品之间 LC3-II 量的差异代表了被递送到溶酶体进行降解的 LC3 量 (图 6D)[15]。

图 6. 自噬体数量和自噬通量的监测方法[15]。
其次,可以通过免疫印迹分析或流式细胞术定量或通过荧光显微镜定性观察总细胞 LC3 的量,与自噬通量成反比。除了 LC3 之外,其他自噬底物的水平也可用于监测自噬通量 (图 6)。

本期小 M 为大家总结了细胞自噬的类型、相关机制图及特征等相关基础知识,并介绍了自噬的细胞保护与促死亡的双重功能,最后为大家整理了有关细胞自噬的相关检测方法!那本期就到这里啦~咱们下期再见~

|
Chloroquine 是自噬 (autophagy) 和 Toll 样受体 (TLRs) 的抑制剂。Chloroquine 有效抑制 SARS-CoV-2 (COVID-19) 感染 (EC50=1.13 μM)。 |
|
Hydroxychloroquine 可以抑制 Toll 样受体 7/9 (TLR7/9) 信号传导。Hydroxychloroquine 有效抑制 SARS-CoV-2 感染。 |
|
Vorinostat (SAHA) 是一种有效的,可口服的 HDAC1,HDAC2,HDAC3 (Class I),HDAC6 和 HDAC7 (Class II) 和 Class IV (HDAC11) 的抑制剂。 |
|
Sorafenib 诱导细胞自噬 (autophagy) 和凋亡 (apoptosis),并具有抗肿瘤活性。Sorafenib 也是一种 ferroptosis 激动剂。 |
|
Dactolisib (BEZ235) 是一种具有口服活性的、双重的 pan-class I PI3K 和 mTOR 抑制剂。Dactolisib (BEZ235) 抑制 mTORC1 和 mTORC2。 |
|
EACC 是可逆的自噬 (autophagy) 抑制剂,可阻断自噬通量。EACC 选择性抑制自噬体特异性的 SNARE Stx17 的易位,从而阻止自噬体与溶酶体的融合。 |


[1] Vargas JNS,et al. The mechanisms and roles of selective autophagy in mammals. Nat Rev Mol Cell Biol. 2023 Mar;24(3):167-185.
[2] Aman Y,et al. Autophagy in healthy aging and disease. Nat Aging. 2021 Aug;1(8):634-650.
[3] Noguchi M, et al. Autophagy as a modulator of cell death machinery. Cell Death Dis. 2020 Jul 8;11(7):517.
[4] Denton D, et al. Autophagy-dependent cell death. Cell Death Differ. 2019 Mar;26(4):605-616.
[5] Kroemer G, et al. Autophagy and the integrated stress response. Mol Cell. 2010 Oct 22;40(2):280-93.
[6] Boya P, et al. Inhibition of macroautophagy triggers apoptosis. Mol Cell Biol. 2005 Feb;25(3):1025-40.
[7] Mizushima N. The role of the Atg1/ULK1 complex in autophagy regulation. Curr Opin Cell Biol. 2010 Apr;22(2):132-9.
[8] Bellot G, et al. Hypoxia-induced autophagy is mediated through hypoxia-inducible factor induction of BNIP3 and BNIP3L via their BH3 domains. Mol Cell Biol. 2009 May;29(10):2570-81.
[9] Jung S, et al. Autophagy as a decisive process for cell death. Exp Mol Med. 2020 Jun;52(6):921-930.
[10] Denton D, et al. Autophagy as a pro-death pathway. Immunol Cell Biol. 2015 Jan;93(1):35-42.
[11] Liu J, et al. TMEM164 is a new determinant of autophagy-dependent ferroptosis. Autophagy. 2023 Mar;19(3):945-956.
[12] Basit F, et al. Obatoclax (GX15-070) triggers necroptosis by promoting the assembly of the necrosome on autophagosomal membranes. Cell Death Differ. 2013 Sep;20(9):1161-73.
[13] Li X, et al. Autophagy and autophagy-related proteins in cancer. Mol Cancer. 2020 Jan 22;19(1):12.
[14] Mohsen S, et al. Autophagy Agents in Clinical Trials for Cancer Therapy: A Brief Review. Curr Oncol. 2022 Mar 5;29(3):1695-1708.
[15] Mizushima N, et al. Methods in mammalian autophagy research. Cell. 2010 Feb 5;140(3):313-26.
[16] Martinet W, et al. In situ detection of starvation-induced autophagy. J Histochem Cytochem. 2006 Jan;54(1):85-96.